El flavonoide procianidina C1 tiene actividad senoterapéutica y aumenta la esperanza de vida en ratones.
Abstracto
El deterioro funcional de los órganos asociado al envejecimiento y el aumento del riesgo de patologías crónicas relacionadas con la edad se deben en parte a la acumulación de células senescentes, que desarrollan el fenotipo secretor asociado a la senescencia (SASP). Aquí mostramos que la procianidina C1 (PCC1), un componente polifenólico del extracto de semilla de uva (GSE), aumenta la esperanza de vida y la vida útil de los ratones a través de su acción sobre las células senescentes. Al examinar una biblioteca de productos naturales, encontramos que GSE y PCC1 como uno de sus componentes activos, tienen efectos específicos sobre las células senescentes. A bajas concentraciones, PCC1 parece inhibir la formación de SASP, mientras que mata selectivamente las células senescentes en concentraciones más altas, posiblemente al promover la producción de especies reactivas de oxígeno y la disfunción mitocondrial. En modelos de roedores, PCC1 agota las células senescentes en un microambiente tumoral dañado por el tratamiento y mejora la eficacia terapéutica cuando se coadministra con quimioterapia. La administración intermitente de PCC1 a ratones irradiados, senescentes implantados con células o envejecidos naturalmente alivia la disfunción física y prolonga la supervivencia. Identificamos a PCC1 como un agente senoterapéutico natural con actividad in vivo y alto potencial de desarrollo adicional como una intervención clínica para retrasar, aliviar o prevenir patologías relacionadas con la edad.
El envejecimiento es uno de los mayores factores de riesgo para los trastornos crónicos, incluidas las enfermedades cardiovasculares, los trastornos metabólicos, las patologías neurodegenerativas y diversas neoplasias malignas, que juntas representan la mayor parte de los costos de morbilidad, mortalidad y salud a nivel mundial.1. Se ha logrado un progreso considerable en los últimos años para desarrollar agentes específicos para tratar afecciones individuales relacionadas con la edad, como diabetes tipo 2, osteoporosis, fragilidad esquelética y disfunción vascular. Sin embargo, el efecto combinado de estos medicamentos en el control de la morbilidad y la mortalidad de las enfermedades crónicas ha sido modesto, y estas enfermedades tienden a ocurrir en sincronía como multimorbilidades, con una prevalencia que aumenta exponencialmente después de los 70 años de edad.2. Se han identificado varios factores importantes que afectan la esperanza de vida y la vida útil a través de estudios en una variedad de especies y se han definido como mecanismos de envejecimiento que pueden clasificarse en nueve sellos distintivos.3. De estos mecanismos fundamentales de envejecimiento, la senescencia celular ha recibido una atención sustancial, ya que representa un proceso farmacológico que previene o retrasa múltiples comorbilidades del envejecimiento.4. Reportado por primera vez en la década de 1960, la senescencia celular se refiere a un estado celular que implica una detención replicativa esencialmente irreversible, cambios profundos de cromatina, resistencia a la apoptosis y aumento de la síntesis de proteínas, que con frecuencia culmina en la sobreproducción de citocinas proinflamatorias, una característica denominada SASP, que se cree que Impulsar fenotipos de envejecimiento y diversas patologías relacionadas con la edad.5. Ablación de células senescentes positivas para el marcador de senescencia p16INK4A mitiga la degeneración de los tejidos y extiende la vida útil de los animales, lo que respalda el argumento de que las células senescentes desempeñan un papel causal en el envejecimiento del organismo6,7. El éxito en los estudios preclínicos ha inspirado el inicio de ensayos clínicos de prueba de concepto que involucran senolíticos para varias enfermedades humanas con el potencial de disminuir la carga de células senescentes in vivo a través de la eliminación farmacológica selectiva.8,9,10. Desde el primer descubrimiento en 2015 (ref. 11), ahora se conocen un puñado de agentes senolíticos sintéticos o de moléculas pequeñas. Las estrategias de focalización se basan principalmente en el mecanismo de resistencia de las células senescentes a la apoptosis, que parece depender de las vías antiapoptóticas asociadas a la senescencia que permiten la supervivencia de las células senescentes durante períodos prolongados.12,13. La administración intermitente de senolíticos tiene el potencial de reducir el riesgo de que los pacientes desarrollen condiciones adversas, minimizar los efectos fuera del objetivo de los medicamentos y prevenir el desarrollo de resistencia a los medicamentos de las células senescentes, que no se dividen, una característica que las diferencia de las células cancerosas, ya que las células cancerosas adquieren con frecuencia mutaciones ventajosas que proporcionan resistencia frente a las terapias contra el cáncer. Sin embargo, la mayoría de los senolíticos informados dependen del linaje celular o del tipo celular o, alternativamente, exhiben una citotoxicidad sustancial in vivo, lo que limita su uso potencial para fines clínicos. En este estudio, analizamos una biblioteca de medicamentos de productos naturales compuesta por agentes antienvejecimiento e identificamos varios candidatos, incluido GSE. Un análisis más detallado reveló que PCC1, un componente de epicatequina trímero de tipo B de los flavonoides GSE, desempeña un papel importante en la inhibición de la expresión de SASP a bajas concentraciones y en la muerte de las células senescentes en concentraciones más altas, este último mediante la inducción de apoptosis. Los datos preclínicos sugirieron que, en combinación con la quimioterapia clásica, PCC1 puede reducir significativamente el tamaño del tumor y prolongar la supervivencia en varios modelos de ratón. Por lo tanto, PCC1 representa una nueva clase de senolíticos fitoquímicos aislados de fuentes naturales que retrasan el envejecimiento y mejoran los trastornos relacionados con la edad y justifica una mayor exploración como un agente geroprotector potencial en la medicina clínica. En un esfuerzo por identificar nuevos compuestos que puedan modular eficazmente las células senescentes, se realizó una selección de agentes no sesgada con una biblioteca fitoquímica compuesta por 46 agentes medicinales derivados de plantas (biblioteca PDMA). Empleamos una línea de células estromales de próstata humana normal primaria, PSC27, como modelo basado en células para este propósito. Compuesta principalmente de fibroblastos pero con un porcentaje menor de linajes de células no fibroblásticas que incluyen células endoteliales y células de músculo liso, PSC27 es una línea celular primaria per se y desarrolla un SASP típico después de la exposición a factores estresantes como quimioterapia genotóxica o radiación ionizante.14,15,16,17. Tratamos estas células con una dosis subletal pre-optimizada de bleomicina (50 μg ml−1) y observaron un aumento de la tinción de β-galactosidasa (SA-β-Gal) asociada a la senescencia, una disminución de la incorporación de 5-bromodesoxiuridina y un aumento de los focos de reparación del daño del ADN (DDR) 7-10 días después (Fig. 1a - c). Establecimos una estrategia de detección para comparar los efectos que tenían los medicamentos individuales en el perfil de supervivencia y expresión de las células senescentes (Datos extendidos, Fig. 1a). Una ventaja prometedora de los agentes senolíticos es inducir selectivamente la muerte programada de células senescentes, como ABT-263, ABT-737 y el uso combinado de dasatinib y quercetina.11,18,19. Primero probamos la eficacia de estos fármacos geroprotectores contra células PSC27 senescentes para demostrar su potencial como modelo celular experimental para el cribado de fármacos. Nuestros datos preliminares sugirieron que cada uno de estos compuestos agotó significativamente las células senescentes pero no las células en proliferación, lo que confirma la viabilidad de usar esta línea estromal para estudios adicionales (Datos extendidos, Fig. 1b). Tras el cribado a gran escala de la biblioteca de PDMA, identificamos varios compuestos con el potencial de matar selectivamente las células senescentes en cultivo (Datos extendidos, Fig. 1c-e). Entre los agentes que mostraron efectos antisenescencia preliminares se encontraban GSE, quercetina, fisetina, curcumina y piperlongumina (Datos extendidos Fig. 1d, e). La quercetina y la fisetina comparten estructuras químicas similares, ejercen efectos medicinales similares y son senolíticos conocidos.11,20,21. La curcumina y la piperlongumina también son compuestos naturales con potencial senolítico recientemente descubierto.22,23. Elegimos centrarnos en GSE, que seguía siendo una fuente en gran medida poco explorada. En condiciones in vitro, GSE suprimió el SASP con máxima eficiencia a 0,1875 μg ml−1 (Datos extendidos Fig. 2a), que encaja con la propiedad de los senomórficos24. Las concentraciones más bajas o más altas de GSE fueron menos eficaces, quizás debido a la inducción de respuestas de estrés celular como resultado de una mayor citotoxicidad (Datos extendidos, Fig. 2a). Usando RNA-seq, encontramos que el tratamiento con GSE alteró significativamente el perfil de expresión de las células senescentes, con 2644 genes regulados negativamente y 1,472 genes regulados positivamente a un cambio de 2,0 veces por gen (PAGS <0.01) (Datos extendidos Fig. 2b). Aunque la expresión de algunos genes no relacionados con el SASP mostró una tendencia similar a la de los factores típicos del SASP (Datos extendidos Fig. 2c), los datos de nuestro análisis de enriquecimiento de conjuntos de genes (GSEA) apoyaron la expresión reducida de firmas moleculares del SASP o la activación del complejo del factor nuclear (NF) -κB, que es un mediador clave del fenotipo proinflamatorio (Datos extendidos, Fig. 2d, e). La translocación nuclear de p65, una de las principales subunidades del complejo NF-κB, se observó en células senescentes, de acuerdo con su participación funcional en la expresión de SASP.14 (Datos extendidos Fig. 2f). Es de destacar que esta tendencia fue antagonizada sustancialmente por GSE a bajas concentraciones (como 0,1875 μg ml−1). Por el contrario, la activación de la señalización de NF-κB no se suprimió, sino que pareció mejorar cuando se usó GSE en concentraciones más altas (como 3.7500 μg ml−1), lo que sugiere respuestas diferenciales de las células senescentes en estas condiciones de tratamiento. La activación de la señalización DDR, como lo demuestra la fosforilación de ATM quinasa en fracciones nucleares, y la expresión del ligando de quimiocina del motivo C-X-C (CXCL) 8, uno de los factores distintivos de SASP, como se observa en las fracciones citoplásmicas, fueron compatibles con NF Activación -κB en estos ajustes (Datos extendidos Fig. 2f). El perfil de interacción proteína-proteína reveló una red altamente activa que involucra múltiples factores significativamente regulados al alza tras la senescencia celular pero regulados a la baja una vez que las células fueron expuestas a GSE (Datos extendidos Fig. 3a). El perfil de la ontología genética reveló que estas moléculas están involucradas funcionalmente en procesos biológicos y asociadas con componentes celulares generalmente consistentes con la naturaleza secretada del SASP (Datos extendidos Fig. 3b, c). Por lo tanto, GSE es un producto natural que tiene el potencial de controlar el perfil proinflamatorio de las células senescentes, el SASP, cuando se usa dentro de un rango de concentración específico. Aunque GSE no fue el único producto natural con eficacia senolítica en nuestros ensayos basados en células (Datos extendidos, Fig. 1d, e), nuestro estudio posterior se centró en gran medida en GSE, ya que su capacidad geroprotectora parecía particularmente llamativa. Dada la eficacia de GSE en la reducción de SASP como agente senomórfico, a continuación interrogamos el potencial de este producto natural para matar células senescentes en concentraciones más altas actuando como senolítico. La tinción de SA-β-Gal indicó que las células senescentes se eliminaron a una concentración de GSE de 0,75 μg ml−1 (Higo. 1a, b). A 3,75 μg ml−1 GSE, se alcanzó una meseta de 20% de supervivencia de células senescentes (Fig. 1a, b). a, Cuantificación de la supervivencia de células PSC27 senescentes mediante positividad para SA-β-Gal. Se aplicó GSE al medio a concentraciones crecientes. CTRL, células de control (proliferativas); SEN, células senescentes; NS, no significativo. PAGS Los valores se calcularon mediante ANOVA de una vía con la prueba de comparación múltiple de Tukey. B, Imágenes representativas que muestran tinción de SA-β-Gal después del tratamiento de células PSC27 con diferentes concentraciones de GSE. Barra de escala, 20 μm. Los datos son representativos de tres experimentos independientes. DMSO, dimetilsulfóxido. C, Análisis de supervivencia de las células PSC27 senescentes y de control tras el tratamiento con GSE (a concentraciones de 0,3750, 0,7500, 1,8750, 3,7500, 7,5000 y 15,0000 μg ml−1, respectivamente). Los datos se muestran como media ± de y se derivaron de tres réplicas biológicas (norte = 3 ensayos independientes). PAGS los valores fueron calculados por dos caras t-pruebas. D, Medición del curso temporal de la viabilidad in vitro tras el tratamiento de células PSC27 senescentes y de control con GSE (3,75 μg ml−1). Los datos se muestran como media ± de y se derivaron de tres réplicas biológicas (norte = 3 experimentos independientes). PAGS los valores fueron calculados por dos caras t-pruebas. Y, Medición de citometría de flujo de células PSC27 senescentes y de control después del procesamiento con un kit de anexina V-FITC y yoduro de propidio (PI) y tinción con 4,6-diamidino-2-fenilindol (DAPI) para determinar el grado de apoptosis. Q1 – Q4, cuartiles 1–4. F, Cuantificación comparativa del porcentaje de viables (Q4, PI-anexina V-) y apoptótico (Q2 y Q3, PI+anexina V+ y PI-anexina V+, respectivamente) células en poblaciones de control o senescentes tratadas con vehículo o GSE durante 3 d (norte = 3 ensayos biológicamente independientes). PAGS los valores fueron calculados por dos caras t-pruebas. gramo, Medida de la señal de fluorescencia de MitoSOX Red, un indicador de superóxido mitocondrial, en células PSC27 en diferentes condiciones. PAGS los valores fueron calculados por dos caras t-pruebas. h, Espectros de masas de alta resolución que muestran el cromatograma de iones totales (TIC) y el cromatograma de pico base de GSE después de realizar HPLC-ESI-QTOF-MS. A menos que se indique lo contrario, las células se sometieron a análisis relevantes 3 d después del tratamiento con GSE en las condiciones de cultivo. cps, recuentos por segundo. Los datos en gráficos de barras y curvas de regresión se muestran como media ± de y son representativos de tres réplicas biológicas. NS, PAGS > 0,05; *PAGS <0,05; **PAGS <0,01; ***PAGS <0,001; ****PAGS <0,0001. Los ensayos de viabilidad celular mostraron que GSE inducía la muerte celular senescente pero no la muerte celular proliferativa a partir de una concentración de 0,75 μg ml−1 (Higo. 1c). A una concentración de 7,50 μg ml−1, el porcentaje de células senescentes supervivientes se redujo a aproximadamente el 10%, mientras que la viabilidad de las células en proliferación no se vio afectada incluso a 15,00 μg ml−1 GSE (Fig. 1c), la concentración más alta utilizada en nuestros ensayos celulares, lo que sugiere una selectividad y especificidad prominentes de GSE contra las células senescentes, que son las principales características de los senolíticos. A continuación, medimos la capacidad de GSE para apuntar diferencialmente a las células senescentes en un curso de tiempo. Tras el tratamiento con GSE a una concentración de 3,75 μg ml−1, la viabilidad de las células senescentes no disminuyó significativamente hasta después de 20 h. La diferencia de viabilidad entre las células senescentes y el control (células en proliferación) alcanzó un máximo a las 32 h, lo que implica una heterogeneidad de la resistencia intrínseca a los senolíticos en las poblaciones de células senescentes (fig. 1d). Como GSE genera distintos efectos contra las células senescentes, analizamos la eficacia de GSE para inducir la apoptosis celular. La citometría de flujo demostró una viabilidad significativamente reducida, mientras que la apoptosis de las células senescentes, pero no la de las células en proliferación, fue elevada (Fig. 1e, f y Fig. complementaria. 2a). La disfunción mitocondrial y los cambios metabólicos se encuentran entre las características distintivas de las células senescentes y el envejecimiento del organismo, eventos que causan estrés oxidativo y producción de especies reactivas de oxígeno (ROS) como el superóxido.3,25. Usamos MitoSOX Red, un indicador de superóxido mitocondrial26, para sondear los cambios intercelulares y descubrió que GSE promovía la generación de ROS mitocondriales en células senescentes pero no en células en proliferación (Fig. 1 g). Por lo tanto, nuestros datos son consistentes con un modelo en el que GSE mata las células senescentes mediante la inducción de la apoptosis y la exacerbación del estrés mitocondrial in vitro. Las semillas de uva representan entre el 38 y el 52%, en base a la materia seca, de las uvas y constituyen una fuente abundante de antioxidantes.27. Aplicamos cromatografía líquida de alta presión (HPLC) acoplada a espectrometría de masas de tiempo de vuelo cuadrupolo (QTOF-MS) equipada con una interfaz de ionización por electropulverización (ESI) para identificar los componentes principales de GSE. Encontramos tres categorías principales de fitoquímicos, incluidos ácidos fenólicos, flavonoides (como flavan-3-ol, procianidinas) y otros compuestos (Fig. 1h y tabla complementaria 1). Entre ellos, se identificaron algunos componentes como procianidinas y sus derivados, que se informó que se dirigen a proteínas mitocondriales y alivian múltiples enfermedades crónicas.28. Sin embargo, los componentes principales que median la función senolítica de GSE siguen sin estar claros en gran medida. Las actividades biológicas informadas de las procianidinas de semillas de uva incluyen la reducción del daño oxidativo, la supresión de la inflamación y la inducción de la apoptosis de las células cancerosas.29,30,31,32. Entre los compuestos individuales que se encuentran en GSE, PCC1 merece una atención especial, ya que se demostró que induce daño al ADN, detiene el ciclo celular y aumenta la expresión de quinasas de punto de control.33. Los datos del análisis preliminar (cromatograma de iones totales) de GSE, una mezcla de agentes fitoquímicos per se, por HPLC-QTOF-MS sugirieron la presencia de PCC1, ya que el perfil de GSE en picos específicos de MS coincidió con el perfil de cromatograma de PCC1 químicamente puro adquirido de una fuente comercial (Fig. 1h y Fig. complementaria. 2b). Se demostró que PCC1 disminuye el nivel de BCL-2 pero aumenta la expresión del regulador BAX y las actividades de las caspasas 3 y 9 en células cancerosas cultivadas, lo que genera potencialmente efectos anticancerígenos a través de la inducción de la apoptosis.33. Por lo tanto, a continuación evaluamos la capacidad y selectividad de PCC1 para eliminar las células senescentes en cultivo. Los datos sugieren que PCC1 es senolítico para las células estromales senescentes a partir de una concentración de 50 μM, en la que las células en proliferación no se ven afectadas en gran medida (Fig. 2a, b y tabla complementaria 2). Aunque concentraciones más altas causaron una menor tasa de supervivencia de las células senescentes, con un umbral de aproximadamente 200 μM, PCC1 solo exhibió toxicidad hacia las células de control cuando se usó a 600 μM o más (Fig. 2b). Un curso temporal de la actividad de la caspasa 3/7 indicó que PCC1 ejercía efectos apoptóticos dentro de las 12 h, alcanzando una meseta a las 24 h (Fig. 2c). Este hallazgo fue en gran parte consistente con las mediciones de viabilidad (Fig. 2d). La naturaleza senolítica de PCC1 fue confirmada por células que entraron en senescencia debido a agotamiento o senescencia replicativa (RS) u oncogén (HRASG12V) sobreexpresión (OIS), que genera agresiones estresantes similares a las de la senescencia inducida por la terapia (fig. 2e, Datos extendidos Fig. 4b - e y tabla complementaria 2). Juntos, los resultados sugieren que PCC1 aclara selectivamente las células estromales humanas senescentes inducidas por diferentes estímulos de una manera dependiente de la dosis, pero sin un efecto significativo sobre las células no senescentes cuando se usa en concentraciones apropiadas. a, Medición de la supervivencia de las células PSC27 senescentes mediante tinción con SA-β-Gal. Se aplicó PCC1 a concentraciones crecientes. PAGS Los valores se calcularon mediante ANOVA de una vía con la prueba de comparación múltiple de Tukey. B, Supervivencia de células PSC27 senescentes inducida por bleomicina a concentraciones crecientes de PCC1. C, Ensayo apoptótico para la actividad de caspasa 3/7. D, Curvas de supervivencia en el curso del tiempo para evaluar la viabilidad de las células PSC27 después del tratamiento con PCC1. Y, Imágenes de tinción de SA-β-Gal. TIS, senescencia inducida por terapia (por bleomicina). Barra de escala, 20 μm. Los datos son representativos de tres experimentos independientes. F, Citometría de flujo después del procesamiento con un kit de anexina V-FITC y PI y tinción DAPI para determinar los niveles de apoptosis. gramo, Cuantificación del porcentaje de viables (Q4, PI-anexina V-) y apoptótico (Q2 y Q3, PI+anexina V+ y PI-anexina V+, respectivamente) células después del tratamiento con vehículo o PCC1 durante 3 d (norte = 3 ensayos biológicamente independientes). h, Tinción por inmunofluorescencia de células PSC27. Se indujo RS mediante pases en serie antes del tratamiento con PCC1. Rojo, p16INK4a. Las células en un pase temprano (P10) se usaron como control negativo. Se probó ABT-263 (1,25 μM) como control positivo. Barra de escala, 20 μm. I, Estadísticas de tinción por inmunofluorescencia. j, Actividad senolítica inducida por PCC1 después de la inhibición de pan-caspasa (20 μM QVD-OPh). a, Ensayo de PD de MSC humanas. Se aplicó PCC1 el octavo día después del comienzo de los experimentos como se indica. BLEO, bleomicina. Para C,D,a, los datos se muestran como media ± de y se derivaron de tres réplicas biológicas (norte = 3 ensayos independientes). Para datos en B-D,gramo,I,j, PAGS los valores fueron calculados por dos caras t-pruebas. En experimentos para C-a, Se utilizó PCC1 a 100 µM. A menos que se indique lo contrario, se recolectaron muestras para análisis 3 días después del tratamiento con PCC1. Los datos en los gráficos de barras se muestran como media ± de y son representativos de tres réplicas biológicas. NS, PAGS > 0,05; *PAGS <0,05; **PAGS <0,01; ***PAGS <0,001; ****PAGS <0,0001. Para expandir experimentalmente y establecer la eficacia de PCC1 a través de linajes celulares, tratamos fibroblastos de pulmón fetal humano (WI38), células endoteliales de vena umbilical humana primaria (HUVEC) y células madre mesenquimales humanas (MSC) con PCC1 y descubrimos que las células senescentes de todos estos linajes exhibían susceptibilidad similar para la ablación selectiva por PCC1, mientras que sus contrapartes no senescentes permanecieron viables (Datos extendidos Fig. 4f – h y tabla complementaria 3). Además, confirmamos la inducción de apoptosis en células senescentes en respuesta a PCC1 mediante citometría de flujo, mientras que las células en proliferación no se vieron afectadas en gran medida por PCC1 (Fig. 2f, g). En resumen, nuestros datos muestran que PCC1 elimina selectivamente las células senescentes en varios tipos de células y que surgen de diferentes desencadenantes de la senescencia. Para visualizar el agotamiento de las células senescentes por PCC1, examinamos la expresión de p16INK4a, un marcador de senescencia ampliamente utilizado, en células estromales que experimentaron RS. PCC1 eliminó eficazmente las células senescentes positivas para p16, que solo aparecieron en poblaciones de PSC27 de pasaje tardío, con una eficacia muy parecida a la de ABT-263 (1,25 μM), un agente senolítico sintético bien establecido18,21 (Higo. 2h, yo). Para corroborar que la eliminación de células senescentes mediada por PCC1 se produce principalmente a través de la inducción de la apoptosis, más que a través de otras formas de muerte celular programada, tratamos las células con el inhibidor de la apoptosis pan-caspasa quinolil-valyl-EL-metilaspartil - (- 2,6-difluorofenoxi) -metilcetona (QVD-OPh). La capacidad de PCC1 para matar células senescentes se invirtió con QVD-OPh. Por tanto, PCC1 comparte su inducción de apoptosis dependiente de caspasa como una característica senolítica con ABT-263 (Fig. 2j). Un análisis adicional con inhibidores químicos excluyó la muerte celular inducida por PCC1 a través de ferroptosis, piroptosis o necroptosis (Datos extendidos, Fig. 4i). Para evaluar el potencial de duplicación de la población celular (DP) después del tratamiento con fármacos genotóxicos, empleamos MSC, que pueden autorrenovarse y reanudar la proliferación basada en colonias incluso después de la exposición a tensiones ambientales.34, probablemente debido a la heterogeneidad del daño, con células que experimentan menos daño, presumiblemente capaces de retener el potencial de auto-recuperarse y volver a entrar en el ciclo celular.24,35. A diferencia de las células dañadas con bleomicina, que entraron rápidamente en la detención del crecimiento después del tratamiento, el tratamiento posterior a la senescencia con PCC1 mejoró significativamente la capacidad de DP de las MSC, especialmente después de la eliminación de las células senescentes que desarrollan SASP y tienen el potencial de inducir la senescencia paracrina dentro de las poblaciones celulares (Fig. . 2k). Sin embargo, el tratamiento con PCC1 no afectó a la PD de las células en proliferación, lo que es más indicativo de la selectividad de PCC1 por las células senescentes en comparación con sus contrapartes normales. Dado que GSE es una mezcla fitoquímica compleja, muchos de sus componentes tienen actividades antioxidantes y antiinflamatorias27,36, investigamos si PCC1 era el componente principal de GSE involucrado en el agotamiento de las células senescentes o si los fitoquímicos alternativos en GSE podrían contribuir a su efecto senolítico general. Con este fin, examinamos la influencia de las moléculas fitoquímicas individuales en la supervivencia de las células PSC27 senescentes. La mayoría de los componentes de GSE no mostraron actividad senolítica en el rango de dosis de PCC1 y no causaron una muerte significativa de las células en proliferación (Figs. Suplementarias. 3 y 4). Aunque el flavonoide quercetina mostró actividad senolítica como en nuestros estudios anteriores, una propiedad compartida con las flavonas naturales11,21, 'GSE reconstituido', que consiste en los componentes principales mezclados de acuerdo con su porcentaje de masa según lo revelado por nuestros datos de HPLC-QTOF-MS (Tabla complementaria 1, tenga en cuenta que la quercetina representa solo el 0,9%) pero excluyendo deliberadamente PCC1, no mostró resultados similares a los observados para PCC1 en ambos ensayos (Figs. 3 y 4). Aunque no podemos concluir si otros componentes tienen una contribución, nuestros datos sugieren claramente que PCC1 es un mediador principal del efecto senolítico de GSE. Dada la destacada eficacia de PCC1 en la inducción selectiva de la muerte celular senescente, interrogamos el mecanismo o mecanismos subyacentes. PCC1 pertenece a la superfamilia de flavonoides, que pueden eliminar radicales libres, quelar metales y reducir la formación de hidroperóxido, propiedades antioxidantes atribuibles al grupo funcional '-OH' en la estructura y su posición en el anillo de la molécula flavonoide.27. La capacidad antioxidante de las procianidinas depende, en parte, de su grado de polimerización, mientras que PCC1 es un trímero de procianidina epicatequina por naturaleza (Fig. 3a). a, Estructura química de la epicatequina trimérica PCC1. B, Mapa de calor que representa los genes superiores (50) significativamente regulados al alza en las células senescentes PSC27 pero regulados negativamente con el tratamiento con PCC1 (50 μM). Estrellas rojas, factores SASP. C, Gráfico de GSEA de un conjunto de genes significativo en el espectro SASP. FDR, tasa de falsos descubrimientos; NES: puntaje de enriquecimiento normalizado. D, Gráfico de GSEA de un conjunto de genes significativo asociado con la señalización mediada por NF-κB. Y, NetworkAnalyst mapa de interacciones proteína-proteína de factores típicos asociados a SASP significativamente regulados al alza en las células senescentes pero regulados negativamente por el tratamiento con PCC1. F, Mapa de calor que muestra la expresión diferencial de genes de la familia BCL-2 en células de control, senescentes y senescentes tratadas con PCC1. gramo, Inmunotransferencia de células PSC27 expuestas a diferentes agentes. Se examinó la expresión de factores proapoptóticos y antiapoptóticos y moléculas asociadas a la señalización DDR. Caspasa 3 (t), caspasa 3 total; caspasa 3 (c), caspasa 3 escindida; p, fosforilado. β-actina y GAPDH, controles de carga. Los datos son representativos de tres experimentos independientes. h, Las células se infectaron con tres especies diferentes de ARN en horquilla corta dirigidas LESIÓN o PUMA antes de exponerse a bleomicina para inducir la senescencia. Siete días después, las células se trataron con PCC1 (100 µM) durante un período de 3 días para inducir la apoptosis. SCR, revolver. I, LESIÓN La expresión se determinó mediante PCR cuantitativa con transcripción inversa (RT-qPCR). Las células se trataron con bleomicina para inducir la senescencia antes de la exposición a PCC1 100 μM durante 3 días en ausencia o presencia de MK2206 10 μM, ruxolitinib 10 μM o BMS-582949 20 nM para inhibir la actividad de AKT, JAK1 y / o JAK2 o p38 MAPK, respectivamente. j, Un conjunto similar de ensayos de expresión RT-qPCR para PUMA usando las condiciones descritas en I. a-metro, Medición de la viabilidad celular después del tratamiento con PCC1 en ausencia o presencia de MK2206 (a), ruxolitinib (L) o BMS-582949 (metro), incluido para inhibir la actividad enzimática de AKT, JAK1 y / o JAK2 o p38 MAPK, respectivamente. Para datos en C,D, PAGS Los valores se calcularon mediante ANOVA de una vía con comparación post hoc de Tukey. Significación estadística en h-metro se calculó utilizando dos caras t-pruebas o ANOVA unidireccional (prueba de Dunnett). Los datos en todos los gráficos de barras se muestran como media ± de y representan tres réplicas biológicas. NS, PAGS > 0,05; *PAGS <0,05; **PAGS <0,01; ***PAGS <0,001; ****PAGS <0,0001. Primero analizamos el impacto de PCC1 en la expresión de todo el transcriptoma de las células senescentes. La bioinformática mostró que 4.406 genes se regularon positivamente y 2.766 genes se regularon negativamente en las células estromales después del tratamiento con PCC1 (Fig. 5a). Observamos una gran variedad de factores SASP, cuya expresión se incrementó notablemente durante la senescencia celular, pero se redujo sustancialmente cuando las células senescentes se expusieron a PCC1 (Fig. 3b). El perfil de GSEA mostró que tanto las firmas SASP como NF-κB fueron reprimidas notablemente por el tratamiento con PCC1 (Fig. 3c, d). Además, notamos múltiples interacciones mutuas o conexiones funcionales entre estos factores regulados al alza durante la senescencia y regulados a la baja después del tratamiento con PCC1 que aparecen en la lista de los principales genes expresados diferencialmente, la mayoría de los cuales eran típicamente factores secretados (Fig. 3e). Para comprender la selectividad de PCC1 para las células senescentes, evaluamos aún más el perfil de expresión transcriptómica y notamos que PCC1 inducía cambios de expresión en algunos miembros de la superfamilia BCL-2 (Fig. 3f). Aunque la señalización de DDR no se vio afectada en gran medida, se observó una regulación ascendente o activación dependiente de PCC1 de la proteína quinasa activada por mitógeno p38 (MAPK), y se produjo la escisión de la caspasa 3 en estas células (Fig. 3g). Aunque la expresión de BCL-xL estaba elevada en las células senescentes en relación con la de sus controles en proliferación, el tratamiento con PCC1 no mejoró aún más su nivel de proteína. Los niveles de los otros dos factores BCL-2, a saber, BCL-2 y BAX, se mantuvieron prácticamente sin cambios. Mientras que NOXA y PUMA (dos miembros de la subfamilia proapoptótica del dominio 3 de homología BCL-2 (BH3) solamente) exhibieron patrones de expresión diferentes durante la senescencia celular, el tratamiento con PCC1 dio como resultado la regulación positiva de ambos factores (Fig. 3g). La eliminación de los factores proapoptóticos de BCL-2 sugirió que NOXA y PUMA mediaron parcialmente las acciones senolíticas de PCC1 (Fig. 3h y datos extendidos Fig. 5a – c). El tratamiento con inhibidores químicos de AKT quinasa, Janus quinasa (JAK) 1, señalización de JAK2 y p38 MAPK también sugirió la participación de estas vías de señalización en la expresión de PMAIP1 (LESIÓN) y BBC3 (PUMA) y apoptosis de células senescentes después del tratamiento con PCC1 (Fig. 3i – m). Como derribando LESIÓN y PUMA inhibió solo parcialmente el efecto senolítico de PCC1 (Fig. 3 h, k - m), investigamos otros posibles mecanismos que conducen a la muerte celular senescente. Debido a que las procianidinas generalmente aumentan la viabilidad celular, disminuyen la producción de ROS y restringen el estrés oxidativo en las células de mamíferos37,38A continuación, preguntamos si se podían observar efectos similares o antioxidantes en las células senescentes expuestas a PCC1. Sorprendentemente, encontramos que sucedía lo contrario, ya que las células PSC27 senescentes mostraban niveles elevados de ROS cuando se trataban con PCC1, en contraste con sus contrapartes en proliferación (Fig. 4a y datos extendidos Fig. 5d, observe las señales de la sonda de diacetato de 2′-7′-diclorodihidrofluoresceína (DCFH-DA)). Tratamiento con HS-1793, un análogo estable del resveratrol que tiene actividad captadora de radicales libres39, bloqueó eficazmente la producción de ROS en células senescentes tratadas con PCC1 (Datos extendidos, Fig. 5e, f), mientras que los niveles de ROS aumentaron aún más después de la exposición de células senescentes tratadas con PCC1 a CCCP, un desacoplador mitocondrial protonóforo40, o ruxotemitida (LTX-315), un péptido catiónico anfipático que induce la permeabilización de la membrana mitocondrial externa41, cada uno aplicado a concentraciones que no eran citotóxicas para las células de control (Datos extendidos, Fig. 5e, f). Aunque el tratamiento con CCCP o ruxotemitida per se también provocó una mayor producción de ROS, los efectos fueron generalmente menores que los inducidos por PCC1, lo que sugiere que PCC1 desencadena una disfunción mitocondrial en las células senescentes. Al medir el índice apoptótico de las células senescentes (actividad de caspasa 3/7), encontramos que el efecto inducido por PCC1 podría mejorarse aún más con la combinación de PCC1 con cada disruptor mitocondrial, pero suprimido con el tratamiento conjunto con HS-1793 (Datos extendidos Fig. . 5g). a, Medición de los niveles de ROS con DCFH-DA, una sonda fluorescente permeable a las células sensible a los cambios en el estado redox celular. Los experimentos se realizaron 1 día después del tratamiento con PCC1. Izquierda, imágenes representativas. Barra de escala, 10 μm. Bien, estadísticas. DCF, diclorodihidrofluoresceína. B, Inmunoblot tras la exposición de las células a diferentes tratamientos. La distribución del citocromo c entre las mitocondrias y el citoplasma fue perfilada aislando las mitocondrias de los sobrenadantes del citosol 3 días después del tratamiento con PCC1. COX IV es la enzima terminal de la cadena respiratoria mitocondrial y un marcador mitocondrial. C, Curvas de supervivencia en el tiempo para evaluar la viabilidad de las células PSC27 tras el tratamiento con PCB2, otro miembro de la familia de las procianidinas naturales. Los datos se muestran como media ± de y se derivaron de tres réplicas biológicas (norte = 3 ensayos independientes). D, Ensayo de producción de ROS realizado de manera similar a como se describe en a, excepto que las células estuvieron expuestas a PCB2. Barra de escala, 10 μm. Y, Inmunotransferencia de la expresión y distribución de ATM, p53 y caspasa 3 entre el citoplasma y el núcleo. GAPDH y lamin A / C, controles de carga para citoplasma y núcleos, respectivamente. C1, PCC1; B2, PCB2. F, Microscopía confocal de tinción por inmunofluorescencia después del tratamiento de células con vehículo (DMSO) o PCC1. Se aplicaron anticuerpos primarios específicos para p53 o COX IV. Barra de escala, 10 μm. gramo, Análisis de inmunotransferencia de células PSC27 expuestas a diferentes agentes. Cito, citoplasmático; mito, mitocondrial. h, Análisis de tinción JC-1, una sonda fluorescente indicativa de Δψm. Las señales se midieron durante 3 d. La fluorescencia verde indica monómeros JC-1 (aparecen en el citosol después de la despolarización de la membrana mitocondrial e indican apoptosis en etapa temprana). La fluorescencia roja indica agregación de JC-1 (reside en mitocondrias intactas). Izquierda, imágenes representativas. Bien, estadísticas. Tanto PCC1 como PCB2 se utilizaron a 100 μM en ensayos relevantes. Datos en B,Y-gramo son representativos de tres experimentos independientes. Significación estadística en a (derecho), D (Derecha y h (derecha) se calculó utilizando dos caras t-pruebas, y eso en C se calculó con ANOVA de una vía (prueba de Dunnett). Los datos en todos los gráficos de barras se muestran como media ± de y son representativos de tres réplicas biológicas. NS, PAGS > 0,05; *PAGS <0,05; **PAGS <0,01. La liberación del citocromo c y la alteración de la membrana mitocondrial son eventos intracelulares asociados con la apoptosis y, a menudo, actúan como impulsores apoptóticos directos.42. Nuestros datos sugieren que el tratamiento con PCC1 mejoró la liberación de citocromo c de las mitocondrias al espacio citoplásmico circundante (Fig. 4b y datos extendidos Fig. 5h). La liberación de citocromo c de las mitocondrias es en gran medida consistente con reacciones bioquímicas como la activación de caspasa en células senescentes tratadas con PCC1 (Fig. 3g). Los miembros de la familia de las procianidinas exhiben un amplio espectro de propiedades farmacológicas que incluyen antioxidantes y antiinflamatorias, que son lo opuesto a lo que observamos al tratar células senescentes con PCC1. Los datos actuales nos llevaron a razonar si los efectos de PCC1 son reproducidos por otras procianidinas. La procianidina B2 (PCB2) es un flavonoide representativo que existe como dímero y reduce los niveles de ROS durante el estrés oxidativo en células cultivadas.43. PCB2 no logró eliminar las células senescentes (Fig. 4c y Figs. suplementarias. 3b y 4b) y ni la producción mejorada de ROS ni la liberación mitocondrial inducida del citocromo c en las células senescentes (Fig. 4d y datos extendidos Fig. 5i). Una cantidad sustancial de p65 (RelA), una de las principales subunidades del complejo NF-κB, se translocó al núcleo de las células senescentes (Fig. 4e). Aunque el tratamiento con PCB2 contrarrestó la translocación nuclear de p65, lo cual es consistente con su capacidad antiinflamatoria, este efecto no fue reproducido por PCC1 (fig. 4e). Las células senescentes expuestas a PCC1 exhibieron una notable escisión de la caspasa 3, mientras que las tratadas con PCB2 no lo hicieron, diferenciando aún más la actividad biológica de estas dos moléculas de procianidina (Fig. 4e). Como factor que gobierna funcionalmente el destino celular, p53 puede inducir la apoptosis transactivando genes proapoptóticos o de una manera independiente de la transcripción mediante la translocación a las mitocondrias.44. Observamos un aumento de la translocación nuclear de p53 tras la senescencia celular, un patrón notablemente reducido por PCC1, pero mucho menos que el de PCB2 (Fig. 4e, f). Dado que la exclusión nuclear de p53 es un paso crítico en la inducción de la apoptosis de células senescentes45, evaluamos además la distribución de p53. La tinción de inmunofluorescencia indicó una superposición sustancialmente aumentada de p53 con la subunidad IV de la citocromo c oxidasa (COX IV) (un complejo proteico transmembrana en la cadena de electrones respiratorios mitocondriales, que a menudo se utiliza como marcador proteico residente mitocondrial) en células senescentes tratadas con PCC1, lo que sugiere una mayor translocación de p53 en la matriz mitocondrial. Aunque observamos algo de p53 en las mitocondrias de las células en proliferación, PCC1 no indujo un influjo notable o completo de la proteína p53 en la matriz mitocondrial de las células en proliferación (Fig. 4f). Sin embargo, en las células senescentes, los niveles de p53 disminuyeron en los núcleos pero aumentaron en las mitocondrias tras la exposición a PCC1 (Fig. 4g). La disminución del potencial de membrana mitocondrial (Δψm) es un evento que puede desencadenar la apoptosis a través de la vía intrínseca mediada por mitocondrias46. Encontramos que Δψm se redujo significativamente en las células senescentes, mientras que las células en proliferación permanecieron básicamente inalteradas en presencia de PCC1, como lo indica el perfil de las señales de la sonda JC-1 (Fig. 4h). Por lo tanto, PCC1 promueve la generación de ROS, desencadena la liberación de citocromo cy provoca una alteración de Δψm en las células senescentes, eventos inherentemente asociados con la discapacidad mitocondrial y que impulsan funcionalmente la apoptosis celular. Juntos, nuestros datos experimentales sugieren que las células senescentes están sujetas a apoptosis inducida por PCC1, un proceso parcialmente mediado por LESIÓN y PUMA regulación positiva y asociado con una mayor producción de ROS y disfunción mitocondrial. Dada la capacidad y selectividad de PCC1 para eliminar células senescentes in vitro, a continuación nos preguntamos si este agente podría aprovecharse para intervenir contra patologías relacionadas con la edad in vivo. En oncología clínica, la resistencia a los medicamentos limita la eficacia de la mayoría de los tratamientos contra el cáncer, mientras que las células senescentes con frecuencia contribuyen a la resistencia terapéutica a través del desarrollo de un SASP in vivo en el microambiente tumoral dañado por medicamentos (TME).15,16,47. La eliminación farmacológica de las células senescentes inducidas por la terapia minimiza los efectos secundarios de la quimioterapia y previene la recurrencia del cáncer en animales.48. Sin embargo, la viabilidad del agotamiento de las células senescentes de los tumores primarios mediada por PCC1 para mejorar la eficacia de los tratamientos contra el cáncer sigue siendo en gran parte desconocida. Primero, elegimos construir tejidos recombinantes mezclando células PSC27 con células PC3, que son una línea celular típica de cáncer de próstata de alta malignidad, en una proporción pre-optimizada (1: 4).14. A continuación, las células se implantaron por vía subcutánea en el flanco trasero de ratones con diabetes no obesos e inmunodeficiencia combinada grave (NOD-SCID). Se midieron los tumores de los animales al final de un período de 8 semanas y se adquirieron tejidos para la evaluación patológica. En comparación con los tumores que comprenden células cancerosas PC3 y células estromales PSC27 vírgenes, los xenoinjertos compuestos de células PC3 y células PSC27 senescentes exhibieron un volumen significativamente mayor, lo que confirma los efectos de promoción del crecimiento tumoral de las células senescentes (Datos extendidos, Fig. 6a). Para imitar las condiciones clínicas, diseñamos experimentalmente un régimen preclínico que incorpora terapias genotóxicas y / o senolíticos (Fig. 5a). Dos semanas después de la implantación subcutánea, cuando se observó una captación estable de tumores in vivo, se administró una dosis única de mitoxantrona (MIT, un fármaco quimioterapéutico) o placebo a los animales el primer día de la tercera, quinta y séptima semanas hasta el final de el régimen de 8 semanas (Datos extendidos Fig. 6b). A diferencia del grupo tratado con placebo, la administración de MIT retrasó notablemente el crecimiento del tumor, validando la eficacia de MIT como agente quimioterapéutico (reducción del 44,0% en el tamaño del tumor) (Fig. 5b). En particular, aunque la administración de PCC1 en sí no provocó la reducción del tumor, el tratamiento con MIT seguido de la administración de PCC1 (a 20 mg por kg mediante inyección intraperitoneal (ip) 2 semanas después de la primera dosis de MIT y luego administrada cada dos semanas) mejoró notablemente la regresión del tumor (55,2 % de reducción en el tamaño del tumor en comparación con MIT solo; 74,9% de reducción en el volumen del tumor en comparación con el tratamiento con placebo) (Fig. 5b). a, Diagrama ilustrativo de un régimen preclínico. Dos semanas después de la implantación subcutánea y la absorción in vivo de recombinantes tisulares, los ratones macho NOD-SCID recibieron agentes únicos (mono) o combinados (duales) en un programa metronómico compuesto por varios ciclos. BLI, imágenes de bioluminiscencia. B, Perfilado estadístico de los volúmenes finales del tumor. Las células PC3 se xenoinjertaron solas o junto con células PSC27 en el flanco trasero de los animales. C, Evaluación comparativa de la senescencia in vivo mediante tinción con SA-β-Gal. Los tumores se disecaron recientemente después de matar animales y se procesaron como secciones congeladas para tinción histológica. Barras de escala, 200 μm. D, Gráficos de violín que representan estadísticas comparativas de tinción de SA-β-Gal en tejidos tumorales. Y, Ensayo de transcripción para la expresión in vivo de varios factores SASP canónicos en células estromales aisladas de tumores. Los tejidos de animales xenoinjertados con células estromales y cancerosas se sometieron a un aislamiento apoyado por microdisección por captura con láser y procesos posteriores. Los datos son representativos de tres réplicas biológicas (norte = 10 animales por grupo). Los conjuntos de datos se muestran como diagramas de caja y bigotes, en los que una caja se extiende desde el percentil 25 al 75 con la mediana mostrada como una línea en el medio y los bigotes indican los valores más pequeños y más grandes. F, Perfilado de transcripciones SASP en células estromales. Las señales correspondientes a cada factor se normalizaron a las del grupo tratado con vehículo. Nota p16INK4a también se conoce como CDKN2A y p21CIP1 también se conoce como CDKN1A. gramo, Medición estadística de células con daño en el ADN y células apoptóticas en bioespecímenes recolectados como se describe en a,B. Los valores se presentan como el porcentaje de células teñidas positivamente por inmunohistoquímica (IHC) con anticuerpos específicos para histona γH2AX o caspasa 3 (escindida). Para B,D-gramo, PAGS los valores fueron calculados por dos caras t-pruebas. h, Imágenes IHC representativas de caspasa 3 (escindida, CC3) al final de los regímenes terapéuticos. Barras de escala, 100 μm. I, Supervivencia comparativa de ratones muertos después del desarrollo de enfermedades voluminosas avanzadas. La duración de la supervivencia se calculó desde el momento de la inyección de tejido recombinante hasta la muerte del animal. EM: mediana de supervivencia. PAGS los valores se calcularon mediante pruebas de rango logarítmico bilateral (Mantel-Cox). Datos en C,h son representativos de tres experimentos independientes. Los datos en todos los gráficos de barras se muestran como media ± de y son representativos de tres réplicas biológicas. A continuación, probamos si se producía senescencia celular en los focos tumorales de estos animales. Como era de esperar, la administración de MIT indujo la aparición de un gran número de células senescentes en el tejido tumoral. Sin embargo, la administración de PCC1 a estos animales tratados con quimioterapia agotó la mayoría de las células senescentes (Fig. 5c, d). La microdisección de captura con láser seguida de ensayos de transcripción indicó un aumento significativo de la expresión de factores SASP que incluyen IL6, CXCL8, SPINK1, WNT16B (también conocido como WNT16), GM-CSF (también conocido como CSF2), MMP3 y IL1A, una tendencia acompañada de regulación positiva del gen que codifica el marcador de senescencia p16INK4a en animales tratados con quimioterapia (Fig. 5e y datos extendidos Fig. 6c). Estos cambios se observaron principalmente en las células estromales, más que en las células cancerosas vecinas, lo que implica la posibilidad de repoblación de células cancerosas residuales, que con frecuencia desarrollan resistencia adquirida en la TME dañada por el tratamiento. Sin embargo, tras la administración de PCC1, los cambios asociados a SASP se revertieron en gran medida, como lo sugirieron los ensayos de transcripción y RNA-seq (Fig. 5f y datos extendidos Fig. 6d). Para investigar los mecanismos subyacentes a la expresión de SASP en ratones tratados con MIT, disecamos tumores de animales tratados con estos dos agentes 7 días después de la primera dosis de administración de GSE, un momento antes del desarrollo de colonias resistentes. A diferencia del tratamiento con placebo, la administración de MIT aumentó el daño del ADN y la apoptosis, mientras que el tratamiento con PCC1 solo no lo hizo (Fig. 5g). Sin embargo, cuando a los animales tratados con MIT se les administró conjuntamente PCC1, el daño del ADN y la apoptosis aumentaron significativamente, lo que implica una mayor citotoxicidad en los animales que recibieron tanto quimioterapia como senolíticos. Como evidencia de apoyo, observamos una escisión elevada de la caspasa 3, un sello típico de la apoptosis celular, cuando se administró PCC1 junto con MIT (Fig. 5h). A continuación, evaluamos las consecuencias de la progresión del tumor comparando la supervivencia de diferentes grupos de animales a lo largo del tiempo. En esta cohorte preclínica, se controló el crecimiento tumoral de los animales, y se consideró que la enfermedad voluminosa había surgido una vez que la carga tumoral era prominente (tamaño ≥ 2000 mm3), un enfoque empleado en estudios anteriores14,49. Los ratones que recibieron el tratamiento combinatorio MIT-PCC1 mostraron la mediana de supervivencia más prolongada, sobreviviendo al menos un 48,1% más que el grupo tratado con MIT solo (Fig. 5i, verde versus azul). Sin embargo, el tratamiento con PCC1 solo extendió la supervivencia marginalmente. Nuestros datos sugieren que la administración de PCC1 sola no cambia el crecimiento tumoral ni promueve la supervivencia animal, mientras que la coadministración de PCC1 con MIT tiene efectos sinérgicos significativos. Es de destacar que los tratamientos realizados en estos estudios parecieron ser bien tolerados por los animales, ya que no se observaron alteraciones significativas en los niveles de urea, creatinina o enzimas hepáticas o en el peso corporal (Datos extendidos, Fig. 6e, f). Más importante aún, los agentes quimioterapéuticos y geroprotectores administrados en dosis optimizadas en este estudio no interfirieron significativamente con la integridad del sistema inmunológico o la homeostasis tisular de órganos críticos, incluso en ratones inmunocompetentes (Fig. 6a – c). Estos resultados respaldan el fundamento de que los agentes antienvejecimiento combinados con la quimioterapia convencional tienen el potencial de mejorar la respuesta tumoral sin causar una toxicidad sistémica grave. Incluso una pequeña cantidad de células senescentes puede inducir disfunción física en animales jóvenes50. Preguntamos si PCC1 mata selectivamente las células senescentes in vivo y, por lo tanto, puede prevenir la disfunción física. Para abordar esta cuestión, realizamos una implantación paralela de fibroblastos embrionarios de ratón senescentes y de control (MEF, 0,5 × 106 células por lado) que expresan constitutivamente luciferasa (LUC+) por vía subcutánea en ratones singénicos de tipo salvaje (WT). Inmediatamente después de la implantación, los animales fueron tratados con PCC1 (a 20 mg por kg mediante inyección ip) o vehículo (etanol-polietilenglicol 400-Phosal 50 propilenglicol (PG) a las 10:30:60) durante 7 días (Fig. 6a). Encontramos que las intensidades de la señal de luminiscencia fueron significativamente más bajas en ratones implantados con células senescentes y tratados con PCC1 que en los compañeros de camada tratados con vehículo, aunque no se observaron diferencias después del tratamiento de ratones trasplantados con LUC+ celdas de control (Fig. 6b, c), lo que confirma la eficacia senolítica de PCC1 in vivo. a, Esquema de procedimientos experimentales para trasplante celular y pruebas de función física en ratones machos C57BL / 6J de 5 meses de edad. B, Imágenes representativas que muestran la actividad luciferasa in vivo 2 d después del último tratamiento de ratones. Barras de escala, 20 mm. C, Luminiscencia de células trasplantadas como porcentaje relativo a las señales promedio en animales tratados con vehículo. D-F, Medición de la velocidad máxima al caminar (en relación con la línea de base) (D), resistencia colgante (Y) y fuerza de agarre (F) en ratones macho C57BL / 6J de 5 meses de edad, con pruebas realizadas 1 mes después del último tratamiento. gramo, Esquema del diseño experimental para trasplantes y medidas de función física. h-j, Medición de la velocidad máxima al caminar (en relación con la línea de base) (h), resistencia colgante (I) y fuerza de agarre (j) en ratones macho C57BL / 6J de 28 semanas de edad (2 semanas después del último tratamiento). a, Curvas de supervivencia al año de animales de 17 meses implantados con 0,5 × 106 controlar las células MEF y tratar con vehículo (CTRL-vehículo) y los ratones implantados con 0,5 × 106 células MEF senescentes tratadas con vehículo (SEN-vehículo) o PCC1 (SEN-PCC1). Puntas de flecha rojas, implantación celular (a los 528 días de edad) o al final de la medición de supervivencia (890 días de edad). PAGS los valores se calcularon mediante pruebas de rango logarítmico bilateral (Mantel-Cox). L, Cuantificación comparativa de la carga de enfermedad (izquierda) y la carga tumoral (derecha) (mostrada como mediana con rango intercuartílico) después de la implantación de células senescentes y el tratamiento con vehículo o PCC1. metro, Causa de muerte en animales que recibieron células implantadas y fueron tratados con vehículo o PCC1. Para D-F,h-j, los datos se muestran como diagramas de caja y bigotes, en los que las cajas se extienden desde el percentil 25 al 75 con la mediana mostrada como una línea en el medio, y los bigotes indican los valores más pequeños y más grandes. Para C-F,h-j, PAGS los valores fueron calculados por dos caras t-pruebas. Número de animales, norte = 5 por grupo para C, norte = 10 por grupo para D-j, norte = 27 para a y norte = 13 para L,metro. NS, PAGS > 0,05; *PAGS <0,05; **PAGS <0,01; ***PAGS <0,001; ****PAGS <0,0001. A continuación, investigamos si matar las células senescentes implantadas utilizando PCC1 podría atenuar los eventos patológicos, específicamente la disfunción física. El tratamiento de animales jóvenes con PCC1 después de la implantación de células senescentes durante 1 semana evitó la disminución de la velocidad máxima de marcha (RotaRod), la resistencia al colgar (prueba de colgar) y la fuerza de agarre (medidor de agarre), cambios observados dentro de 1 mes después del tratamiento con vehículo de otro grupo de ratones portadores células senescentes, en consonancia con el potencial de PCC1 para reducir la disfunción física (Fig. 6d – f). La administración de PCC1 también previno la disfunción física que se produjo en los animales 5 semanas después de la implantación de células senescentes (Fig. 6g). En ratones que albergan células senescentes, un solo ciclo de 5 días de tratamiento con PCC1 mejoró la función física en comparación con el tratamiento con vehículo (Fig. 6 am - d). Es de destacar que la mejora fue detectable 2 semanas después del tratamiento con PCC1 e incluso duró varios meses (Datos extendidos, Fig. 7a, b). En estos dos puntos temporales de la administración de PCC1 (inmediatamente frente a 5 semanas después de la implantación de células senescentes), los efectos beneficiosos de PCC1 parecían ser comparables. Los datos sugieren que el cronograma de la administración de PCC1 puede ser flexible, lo que indica su posible viabilidad clínica. Como las procianidinas derivadas de semillas de plantas suelen tener semividas de eliminación de <12 h51,52, tal mejora sostenida en la función física después de un ciclo único de tratamiento con PCC1 evita la necesidad de un tratamiento continuo con el agente senolítico, lo que implica además que la actividad de PCC1 es suficiente para evitar la disfunción física inducida por células senescentes. A continuación, buscamos evaluar el impacto de las células senescentes o el beneficio de su eliminación en animales de mediana edad. Para ello, empleamos ratones C57BL / 6J de 17 meses, a los que se les implantó MEF control o senescentes. En particular, la supervivencia de los animales portadores de células senescentes y que recibieron tratamiento con vehículo durante el año siguiente fue significativamente menor que la de sus homólogos que recibieron tratamiento con PCC1, con un riesgo de muerte 2,4 veces mayor (índice de riesgo, PAGS = 0.0172) (Fig. 6k). Sin embargo, la carga de enfermedad, la carga tumoral al morir y las causas de muerte no fueron significativamente diferentes entre los ratones tratados con vehículo y los tratados con PCC1 (Fig. 6l, m). Estos datos sugieren que una pequeña cantidad de células senescentes podría afectar la supervivencia a través de un proceso general, como acelerar la progresión del envejecimiento, en lugar de causar alguna patología específica o algunas condiciones individuales. El aumento de la carga de células senescentes da como resultado una disfunción física, una tendencia que se asocia con la mortalidad en la mediana edad, pero que puede posponerse mediante la administración de senolíticos como el PCC1. Los senolíticos agotan las células senescentes en diversos tejidos y órganos en diversas situaciones fisiopatológicas, la mayoría de las cuales se correlacionan con el envejecimiento.53. Para examinar más a fondo el efecto de PCC1 sobre las células senescentes en los organismos y el envejecimiento del organismo, seleccionamos dos modelos animales independientes de senescencia in vivo, incluidos los ratones desafiados a la terapia y los ratones que envejecen naturalmente. Primero, indujimos la senescencia celular exponiendo ratones WT a irradiación de cuerpo entero (WBI) a una dosis subletal (5 Gy), un paso seguido de tratamiento geroprotector con PCC1 (20 mg por kg vía inyección ip) o vehículo (etanol-polietileno glycol 400 – Phosal 50 PG a las 10:30:60) (una vez por semana) (Fig. 7a). Es de destacar que los animales que se habían sometido a WBI manifestaron una apariencia corporal anormal, incluido el pelo marcadamente grisáceo, que, sin embargo, se revirtió en gran medida con la administración de PCC1 (Fig. 7b, c). Se indujeron células senescentes positivas para SA-β-Gal in vivo en estos animales, como lo demuestra el aumento de la positividad de tinción en tejidos cardíacos y pulmonares (Fig. 7d, e). Sin embargo, cuando tratamos con PCC1 mediante inyección ip, el porcentaje de células positivas para SA-β-Gal en tejidos disecados se redujo significativamente, a diferencia del de los ratones tratados con vehículo en la etapa post-WBI (Fig. 7f, g). El tratamiento con PCC1 también disminuyó la expresión de marcadores de senescencia y un subconjunto de factores clave de SASP en comparación con el tratamiento con vehículo (Fig. 7h). En resumen, los datos sugieren que PCC1 puede agotar eficazmente las células positivas para SA-β-Gal, controlar la expresión de SASP y minimizar la carga de células senescentes en condiciones in vivo en ratones. a, Esquema del procedimiento experimental para ratones que experimentaron WBI y pruebas de función física. B, Comparación de instantáneas de cuerpo entero de ratones machos C57BL / 6J que no habían recibido tratamiento previo, expuestos a WBI seguido de tratamiento con vehículo o expuestos a WBI y tratados con PCC1, respectivamente. C, Una imagen en la jaula de los animales descritos en a en condiciones preclínicas. D, Imágenes representativas de tinción con SA-β-Gal de tejido cardíaco de ratones no tratados (sin tratamiento previo) y tratados con WBI sometidos a tratamiento con vehículo o PCC1. Barra de escala, 200 μm. Y, Imágenes representativas de la tinción de SA-β-Gal de tejido pulmonar de ratones como se describe en D. Barra de escala, 200 μm. F, Estadísticas comparativas de tinción con SA-β-Gal de tejido cardíaco de animales examinados en D. gramo, Estadísticas comparativas de tinción con SA-β-Gal de tejido pulmonar de animales examinados en Y. h, Medición cuantitativa de la expresión de SASP a nivel de transcripción en tejidos recolectados de animales tratados en las condiciones descritas en a. I,j, Medición de la distancia de carrera en la cinta de correr (I) y fuerza de agarre (j) de ratones experimentales. Para F-j, PAGS los valores fueron calculados por dos caras t-pruebas. a, Análisis de supervivencia de Kaplan-Meier de ratones C57BL / 6J expuestos a WBI y tratados semanalmente con vehículo o PCC1, con ratones sin tratamiento previo como control sin tratar. IC: intervalo de confianza; HR: índice de riesgo; DFI: intervalo libre de enfermedad. PAGS los valores se calcularon mediante pruebas de rango logarítmico bilateral (Mantel-Cox). Los datos en los gráficos de barras se muestran como media ± de y son representativos de tres experimentos independientes. NS, PAGS > 0,05; *PAGS <0,05; **PAGS <0,01; ***PAGS <0,001; ****PAGS <0,0001. Luego evaluamos el impacto de los tratamientos preclínicos en los parámetros físicos de los ratones. Como era de esperar, WBI comprometió significativamente la capacidad de ejercicio y la fuerza muscular según lo medido por los ensayos de fuerza de agarre y cinta rodante en el grupo de vehículo (Fig. 7i, j). Por el contrario, la administración de PCC1 proporcionó un beneficio sustancial, restaurando estas capacidades. Más importante aún, el tratamiento con PCC1 aumentó la tasa de supervivencia (Fig. 7k). Nuestros resultados indican que la eliminación inducida por PCC1 de las células senescentes positivas para SA-β-Gal podría ser una estrategia eficaz para aliviar la regresión física relacionada con la senescencia y reducir la mortalidad en entornos de envejecimiento prematuro desencadenado por factores de estrés ambientales como la terapia citotóxica. A continuación, buscamos definir el impacto de las células senescentes en la función física en animales que envejecen naturalmente. Para ello, tratamos ratones WT normales de 20 meses con vehículo (etanol-polietilenglicol 400-Phosal 50 PG a las 10:30:60) o PCC1 (20 mg por kg mediante inyección ip) (una vez cada 2 semanas) durante 4 meses (Fig. 8a). La evaluación histológica reveló un porcentaje significativamente elevado de células senescentes positivas para SA-β-Gal en el riñón, hígado, pulmón y próstata de animales envejecidos, que se revirtió con el tratamiento con PCC1 (Fig. 8b, c y datos extendidos Fig. 8a – f). Los resultados de las pruebas físicas mostraron que el PCC1 alivió la disfunción física al mejorar la velocidad máxima al caminar, la resistencia al colgar, la fuerza de agarre, la resistencia en la caminadora, la actividad diaria y el rendimiento del equilibrio del haz de los animales a los que se les administró PCC1 en comparación con los tratados con vehículo (Fig. 8d – i), El peso corporal y la ingesta de alimentos se mantuvieron prácticamente sin cambios en los ratones tratados con PCC1 (Datos extendidos, Fig. 8 g, h). En particular, la expresión de SASP se redujo significativamente en tejidos como los pulmones de los ratones envejecidos tratados con PCC1 en comparación con la del grupo tratado con vehículo (Fig. 8j), un patrón consistente con una menor secreción de factores SASP por tejidos estromales humanos tratados con PCC1 (Fig. 5f). a, Diseño esquemático para el examen físico de ratones machos C57BL / 6J de 20 meses de edad tratados con PCC1 una vez cada 2 semanas (cada dos semanas) durante 4 meses. B, Imágenes representativas de tinción con SA-β-Gal de riñones de ratones jóvenes y ancianos tratados con vehículo o PCC1. Barra de escala, 200 μm. C, Cuantificación de la tinción de SA-β-Gal como se describe en B. Los datos representan la media ± de D-h, Cuantificación de la velocidad máxima al caminar (relativa a la línea de base) (D), resistencia colgante (Y), la fuerza de prensión (F), resistencia en cinta rodante (gramo) y actividad diaria (h) de ratones macho C57BL / 6J de 20 meses de edad después del tratamiento de 4 meses. I, Cuantificación del tiempo necesario para cruzar la barra de equilibrio. Los puntos de datos antes y después del tratamiento de cada animal están conectados para permitir una comparación directa de los efectos del tratamiento. j, Perfil de transcripción cuantitativa de la expresión de SASP en tejidos pulmonares recolectados de ratones de 6 meses sin tratar (6M), tratados con vehículo de 24 meses (vehículo 24M) y tratados con PCC1 de 24 meses (24M-PCC1) . Los datos se muestran como media ± de y se derivaron de tres réplicas biológicas (norte = 3 ensayos independientes). a, Diseño esquemático para análisis de vida útil de ratones (ambos sexos) a los 24-27 meses de edad. L,metro, Supervivencia postratamiento (L) y supervivencia de por vida (metro) curvas de animales C57BL / 6J tratados quincenalmente con PCC1 (norte = 91; 48 machos, 43 hembras) o vehículo (norte = 80; 42 machos, 38 hembras) a partir de los 24-27 meses de edad. norte, La velocidad máxima al caminar y la resistencia al colgar promediadas durante los últimos 2 meses de vida (norte = 10 ratones por grupo) y la esperanza de vida de los ratones más longevos (20 primeros) en ambos grupos. El, Carga de enfermedad y carga tumoral al morir. Para ambos sexos, norte = 60 ratones por brazo. Para hombres, norte = 31 para PCC1 y norte = 33 para vehículo. Para mujeres, norte = 29 para PCC1 y norte = 27 para vehículo. Para C-h,j, norte = 3 ensayos biológicamente independientes. Los datos se muestran como diagramas de caja y bigotes, en los que una caja se extiende desde el percentil 25 al 75 con la mediana mostrada como una línea en el medio, y los bigotes indican los valores más pequeños y más grandes (D-h,norte) o como media ± de (El). No emparejado de dos colas t-pruebas (C-j,norte,El) y modelos de regresión de riesgo proporcional de Cox (L,metro) se utilizaron para determinar la significación estadística. Para establecer el potencial de eliminación de células senescentes para extender la vida útil restante de los ratones WT, realizamos el tratamiento con PCC1 a una edad muy avanzada (Fig. 8k). Los ratones que recibieron la administración de PCC1 (una vez cada 2 semanas o cada dos semanas) a partir de los 24 a 27 meses de edad (aproximadamente equivalente a una edad de 75 a 90 años en humanos) tuvieron una mediana de vida posterior al tratamiento un 64,2% más larga (o un 9,4% más larga en general) vida útil) y menor riesgo de mortalidad (65,0%, PAGS <0,0001) que el grupo tratado con vehículo (Fig. 8l, m). Estos datos indican que PCC1 puede disminuir significativamente el riesgo de mortalidad asociada a la edad en ratones viejos. A continuación, preguntamos si la reducción de la tasa de mortalidad en los animales de edad avanzada se debió a un aumento de la morbilidad en la vejez. Medimos la función física en ratones experimentales tratados con PCC1 o vehículo mensualmente hasta la muerte. A pesar de la vida útil restante más larga en los ratones tratados con PCC1, la función física en los últimos 2 meses de vida no fue significativamente menor que la de los ratones tratados con vehículo (Fig. 8n). Tras la autopsia, la incidencia de varias patologías relacionadas con la edad, la carga tumoral y la causa de muerte no fueron significativamente diferentes entre los ratones tratados con PCC1 y los tratados con vehículo (Fig. 8o y datos extendidos Fig. 9a, b). Sin embargo, la expresión de SASP se redujo en órganos sólidos, lo que fue en gran medida compatible con la disminución de los niveles circulantes de interleucina (IL) -6, factor estimulante de colonias (CSF) 2 y proteína quimioatrayente de monocitos (MCP) 1, marcadores SASP representativos en sangre periférica (Datos extendidos Fig. 9c - f). También observamos una disminución de la expresión de SASP en CD3+ Células T en sangre periférica (Datos extendidos Fig. 9g), un linaje celular que exhibe un fuerte aumento en p16INK4a expresión durante el envejecimiento humano54. Además, el tratamiento con PCC1 redujo el estrés oxidativo en los tejidos del hígado, como lo demuestra una disminución en los aductos del producto de peroxidación lipídica 4-hidroxinonenal (HNE) y un aumento en la proporción de glutatión reducido a oxidado (Datos extendidos Fig. 9h, yo), en consonancia con las propiedades generales de los flavonoides, que ejercen una actividad antioxidante al contrarrestar los radicales libres y activar el sistema de defensa antioxidante.55,56. En resumen, el agente senolítico PCC1, un componente fitoquímico derivado de GSE (o alternativamente, en menor abundancia, de productos naturales como extractos de canela, cacao, cáscaras de manzana y corteza de pino), puede reducir la carga de células senescentes y posiblemente otras. desarrollar un fenotipo proinflamatorio e intrínsecamente dependiente de las vías antiapoptóticas asociadas a la senescencia a favor de la supervivencia y aumentar la vida útil posterior al tratamiento sin causar una morbilidad elevada en ratones. Por la presente presentamos evidencia de prueba de principio de que, incluso cuando se administra en la vejez, dicha modalidad terapéutica tiene un potencial prominente para retrasar notablemente la disfunción relacionada con la edad, reducir las enfermedades relacionadas con la edad y mejorar las condiciones de salud, proporcionando así una nueva vía para mejorar salud y vida útil en la futura medicina geriátrica. El envejecimiento es un proceso esencialmente inevitable que causa progresivamente un deterioro funcional en casi todos los organismos. La senescencia celular, un estado de detención permanente del crecimiento, ha emergido recientemente como un sello y un impulsor del envejecimiento.3,57. Las células senescentes se acumulan en los tejidos envejecidos con el tiempo y contribuyen a una lista cada vez mayor de patologías.58. El aclaramiento de células senescentes de ratones progeroides o envejecidos naturalmente extiende la vida útil, aumenta la vida útil y restringe los trastornos relacionados con la edad que incluyen, entre otros, la aterosclerosis, la osteoartritis y las enfermedades neurodegenerativas.59,60,61,62. Los avances recientes en los estudios relacionados con la edad impulsaron la búsqueda de fármacos que puedan dirigirse selectivamente a las células senescentes, en particular a una nueva clase de agentes geroprotectores denominados senolíticos o, de forma menos agresiva, senomórficos. Hasta la fecha, se han informado algunos senolíticos, incluidos dasatinib y quercetina, fisetina, piperlongumina, inhibidores de la proteína de choque térmico (HSP) 90 e inhibidores de la familia BCL-2 como ABT-263 (navitoclax) y ABT-737 (refs. 11,12,13,18,19,21,22). Entre ellos, los inhibidores de BCL-2 son los senolíticos más utilizados, aunque originalmente se desarrollaron como terapias para el linfoma. ABT-737 se dirige a BCL-2, BCL-xL y BCL-w pero con baja solubilidad y biodisponibilidad oral. Más eficaz para uso in vivo, ABT-263 inhibe principalmente BCL-2 y BCL-xL, mientras que con frecuencia causa trombocitopenia. Dados los marcados efectos secundarios de algunos compuestos senolíticos, existe la necesidad de identificar nuevos compuestos con actividad senolítica pero citotoxicidad reducida. En este estudio, analizamos una biblioteca de fármacos basada en PDMA compuesta principalmente de productos naturales con el objetivo de identificar nuevos agentes que puedan atacar ampliamente las células senescentes con una eficacia y seguridad in vivo óptimas. Como resultado, identificamos PCC1, un agente fitoquímico derivado de fuentes naturales, como un compuesto senolítico de amplio espectro. Como ventaja especial, El PCC1 puede actuar alternativamente como un agente senomórfico para minimizar la expresión de SASP cuando se usa en concentraciones bajas. De hecho, una característica tan ventajosa de PCC1 se parece en gran medida a la de GSE, que puede generar efectos tanto senomórficos como senolíticos. Las estrategias genéticas y farmacológicas demostraron una serie de beneficios de eliminar las células senescentes para retrasar el envejecimiento y controlar las enfermedades. La senescencia celular puede desencadenarse por una variedad de estímulos que van desde la activación oncogénica, el estrés genotóxico hasta la respuesta inflamatoria y el agotamiento replicativo. Varios compuestos se identifican como senolíticos de amplio espectro, mientras que otros son selectivos solo contra cierto tipo de células senescentes. Las diferencias en la especificidad implican elecciones individuales de senolíticos, que dependen principalmente de su uso clínico previsto. Un estudio reciente reveló la ouabaína, un compuesto natural perteneciente a la familia de los glucósidos cardíacos, como un agente senolítico que puede usarse tanto para la eliminación de células senescentes como para la terapia del cáncer, esta última implementada a través de un mecanismo de acción dual.63. En este trabajo, descubrimos PCC1 como otro senolítico nuevo, natural y potente, que induce selectiva y específicamente la apoptosis de las células senescentes pero con una citotoxicidad limitada para las células en proliferación.64. Es de destacar que a concentraciones más bajas, PCC1 inhibe la expresión de SASP, una propiedad compartida por algunos flavonoides derivados de plantas como la apigenina y el kaempferol, que pueden actuar como senomórficos para limitar el impacto de las células senescentes en las condiciones relacionadas con la edad.65,66. Aunque pocos estudios han revelado un mecanismo tan dual de agentes naturales para dirigirse a las células senescentes, la superficie de quercetina sintetizada recientemente funcionalizó Fe3EL4 Las nanopartículas exhibieron potencial senolítico y senomórfico en fibroblastos humanos al mejorar la actividad de la proteína quinasa activada por AMP (AMPK).67. El mecanismo por el cual PCC1 logra efectos senolíticos parece complejo y requiere más estudio. Nuestros datos sugieren que PCC1 deteriora la integridad funcional de las mitocondrias, comprometiendo Δψm, lo que lleva a una mayor producción de radicales libres como ROS y provoca la liberación de citocromo c en las células senescentes pero no en las células en proliferación. Una posible razón de esta especificidad es que las células senescentes tienden a desarrollar una membrana plasmática despolarizada y tienen concentraciones aumentadas de H+ (árbitro. 64), una característica que podría hacerlos más susceptibles a la acción del PCC1. Es de destacar que estas alteraciones van acompañadas de una expresión regulada al alza de factores proapoptóticos, específicamente NOXA y PUMA, eventos que también promueven críticamente la apoptosis de células senescentes. Dentro de la familia de las procianidinas, cuyos miembros se sabe que se derivan de la polimerización de moléculas de flavan-3-ol y existen como oligómeros o polímeros.28, PCC1 parece ser funcionalmente único. Nuestros datos experimentales implican una diferencia notable entre PCC1 (un trímero) y otras procianidinas (la mayoría de las cuales son de hecho monómeros o dímeros, como PCB2). Dado que no analizamos exhaustivamente a los miembros de la familia de la procianidina, si el número de monómeros en la molécula determina su potencial antisenescencia sigue siendo una cuestión abierta pero intrigante, y los mecanismos subyacentes merecen estudios continuos en el futuro. La senescencia celular per se es un proceso muy heterogéneo que depende de diferentes orígenes celulares y estímulos ambientales.68. Una de las características clave de PCC1 es su capacidad para eliminar eficazmente las células senescentes en un amplio espectro de tipos de células y factores estresantes, que incluyen la replicación, los oncogenes, la irradiación y la quimioterapia. En este estudio, comparamos PCC1 con otros senolíticos reportados para efectos sobre células estromales humanas, fibroblastos, HUVEC y MSC, los principales tipos de células en el microambiente tisular. Como se informó, ABT-263 elimina los fibroblastos embrionarios humanos senescentes (HEF) y HUVEC, pero tiene poco efecto sobre los preadipocitos humanos.12,18. El uso combinado de dasatinib y quercetina puede agotar los tres tipos de células senescentes de una manera dependiente de la dosis, pero es tóxico para las células en proliferación.11,69,70. La fisetina, otro flavonoide natural reportado como un agente senolítico, muestra efectos modestos sobre los HEF senescentes y los preadipocitos solo a altas concentraciones.20,21. Por el contrario, PCC1 tiene el potencial de superar estas limitaciones, incluida la dependencia del tipo de célula, alta toxicidad en células no senescentes y baja eficacia contra células senescentes. Aunque, cuando se usa sola, la quercetina (otro flavonoide en GSE) per se mostró citotoxicidad contra las células estromales senescentes, su eficacia es generalmente menor que la de PCC1 (compárese con la Fig. 2a, c y Figs. suplementarias. 3n y 4n). Juntos, PCC1 tiene una actividad senolítica superior con alta especificidad y eficiencia para una gama más amplia de tipos de células que muchos senolíticos reportados como ABT-263, dasatinib, quercetina y fisetina y pueden apuntar a las células senescentes generadas por varios tipos principales de inductores de la senescencia. Encontramos que PCC1 ejerce un efecto inductor de apoptosis en células senescentes en condiciones in vivo. PCC1 eliminó eficazmente las células senescentes inducidas por la terapia y redujo los marcadores de senescencia en órganos sólidos, destacando su eficacia in vivo. En este estudio, también tratamos ratones envejecidos naturalmente con PCC1 y probamos sus efectos sobre las células senescentes, la inflamación crónica y la función física. Primero, el tratamiento con PCC1 agotó las células senescentes en múltiples tejidos y disminuyó las firmas asociadas a SASP como se muestra en el análisis de GSEA. En segundo lugar, PCC1 podría suprimir la expresión de genes asociados a SASP en hígados y riñones envejecidos y reducir la inflamación crónica de bajo grado en la sangre. En tercer lugar, PCC1 alivió la función motora deteriorada, el equilibrio, el ejercicio agotador, la fuerza muscular y la exploración espontánea en ratones de edad avanzada. Más importante, el rendimiento en las pruebas de equilibrio del haz y RotaRod en el grupo tratado con PCC1 mejoró en comparación con el de la condición inicial de pretratamiento. En conjunto, el compuesto fitoquímico PCC1 se dirige selectivamente a las células senescentes en el microambiente tisular y genera efectos biológicos notables en ratones envejecidos naturalmente. De manera similar a las contrapartes sintetizadas químicamente, las procianidinas de origen natural manifiestan actividades antiinflamatorias, antiartríticas, antialérgicas y anticancerígenas, eliminan los radicales libres de oxígeno y suprimen la actividad de peroxidación inducida por radiación.36,71. Como trímero de epicatequina aislado de material vegetal, principalmente de semillas de uva, se demostró que el PCC1 proporciona beneficios para la salud en condiciones patológicas crónicas.72. Sin embargo, la evaluación exhaustiva de los efectos toxicológicos de PCC1 in vivo es crucial para una posible aplicación clínica. Nuestros datos mostraron que el tratamiento con PCC1 de alta concentración (20 mg por kg) y de alta frecuencia (cada dos semanas) no presentaba toxicidades sistémicas aparentes. En resumen, nuestro estudio demuestra la superioridad y la seguridad relativa de una estrategia geroprotectora que se dirige selectivamente a las células senescentes en tejidos envejecidos o dañados por el tratamiento en un amplio espectro de tipos de células. Sin embargo, es posible que las concentraciones de PCC1 in vivo varíen entre órganos y dependan de la dosis administrada, la farmacodinamia y la farmacocinética y que las concentraciones locales no sean lo suficientemente altas para lograr un efecto senolítico en algunos tipos de tejidos. En este caso, En conjunto, nuestro estudio abre una nueva vía para extender la vida útil y prolongar la vida útil y tratar patologías relacionadas con la edad con un agente senoterapéutico (con potencial senomórfico y senolítico), que se deriva de fuentes naturales y posee una eficacia pronunciada. Los posibles efectos antienvejecimiento de PCC1 demostrados en nuestros ensayos preclínicos brindan un buen apoyo para un mayor desarrollo traslacional y clínico de PCC1, con el objetivo general de lograr una vida más larga y saludable.Principal
Resultados
Las bajas concentraciones de GSE restringen la expresión de SASP
GSE tiene actividad senolítica a altas concentraciones.
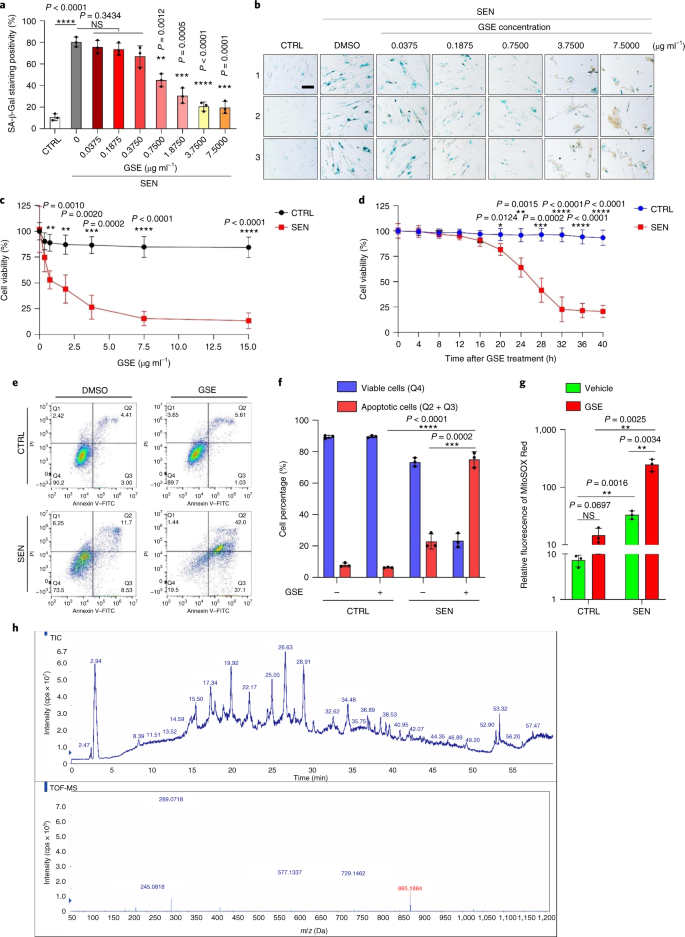
El componente PCC1 de GSE tiene actividad senolítica
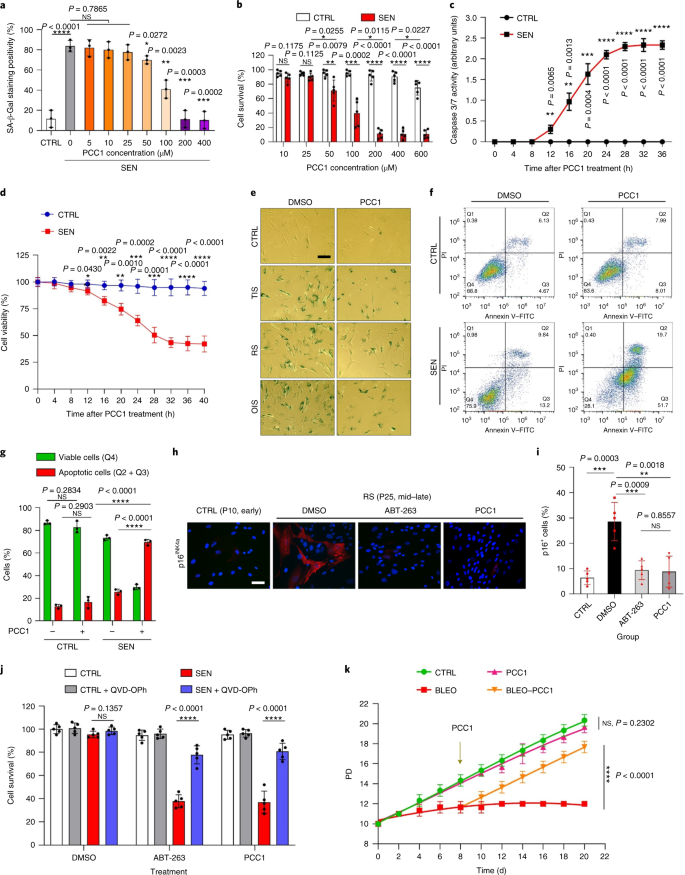
PCC1 induce disfunción mitocondrial en células senescentes
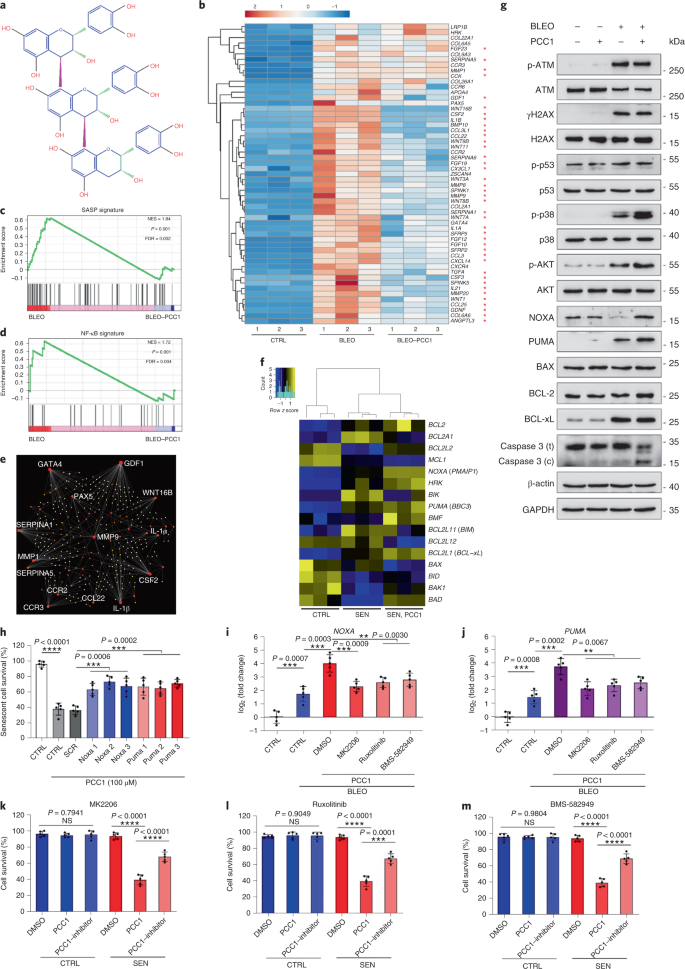
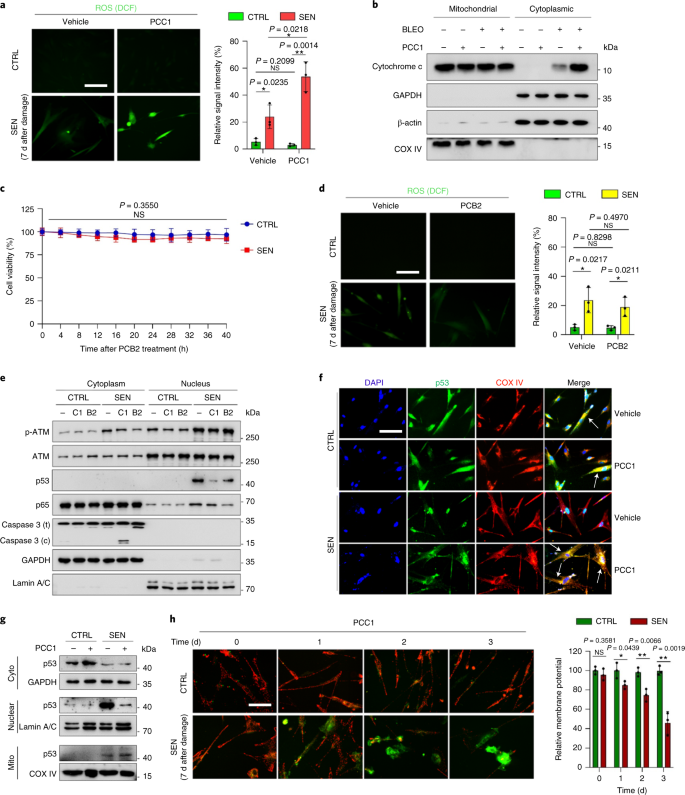
PCC1 promueve la regresión tumoral y reduce la quimiorresistencia

La eliminación de células senescentes como resultado del tratamiento con PCC1 alivia la disfunción física
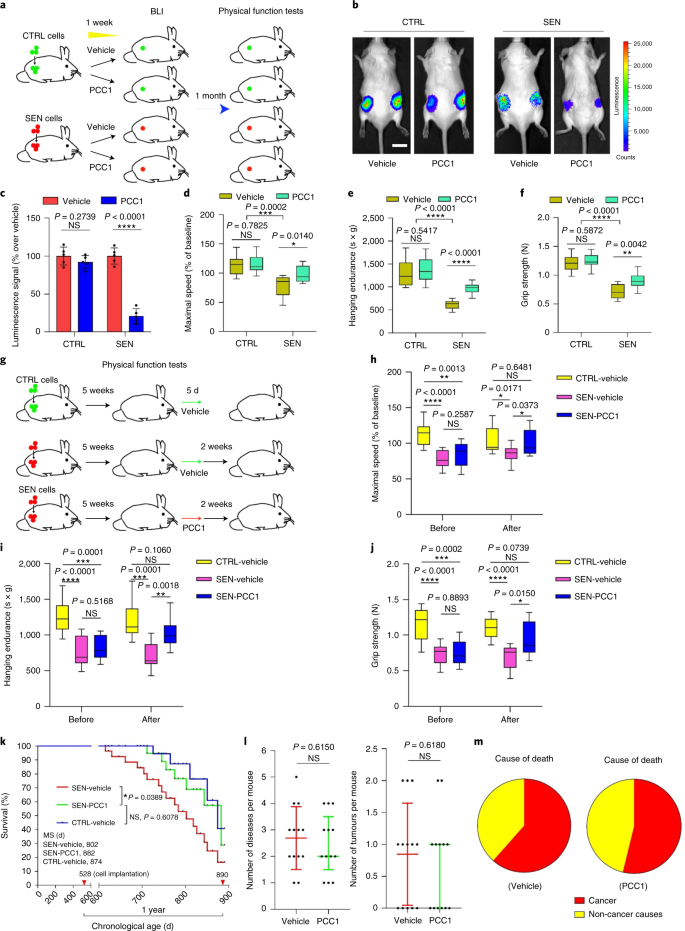
PCC1 mantiene la función física y prolonga la supervivencia de ratones envejecidos
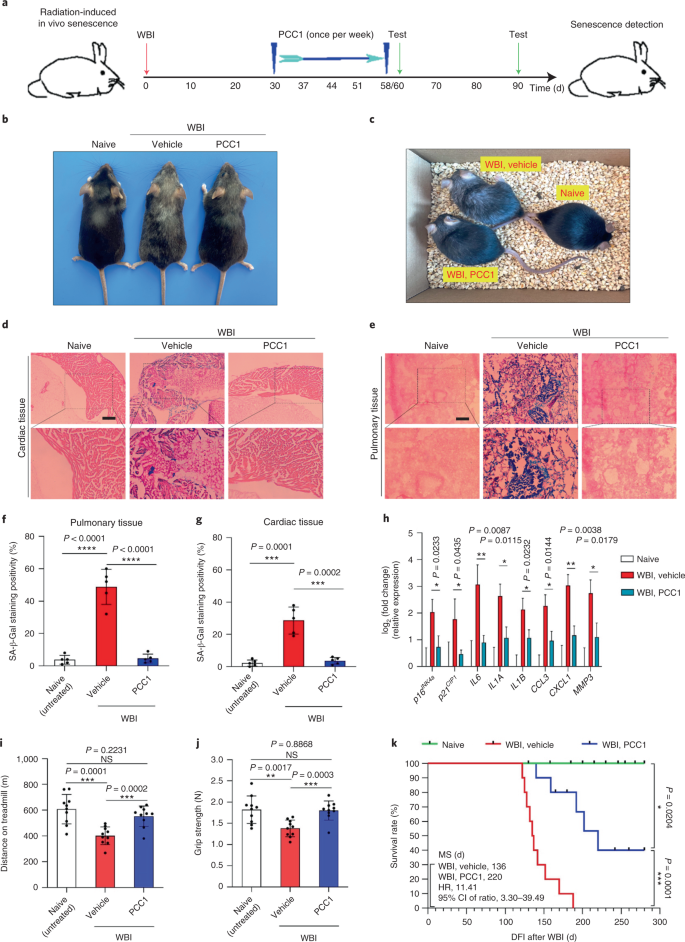
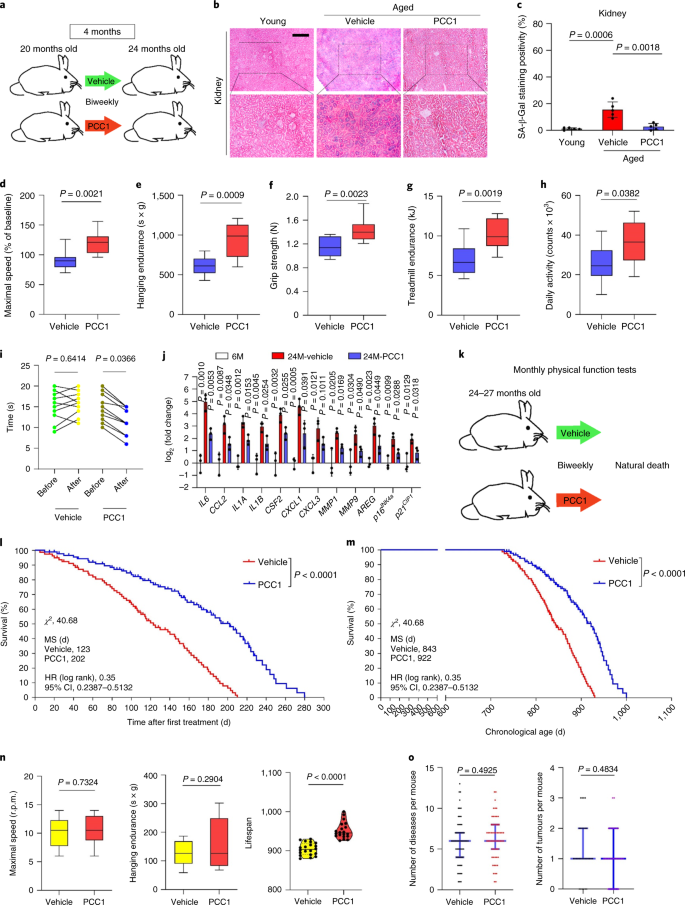
Discusión




